Yurii Mongol
0
2038
453
I slutningen af det 19. århundrede offentliggjorde den russiske kemiker Dmitri Mendeleev sit første forsøg på at gruppere kemiske elementer i henhold til deres atomvægte. Der var kun cirka 60 elementer kendt på det tidspunkt, men Mendeleev indså, at når elementerne var organiseret efter vægt, forekom visse typer elementer i regelmæssige intervaller eller perioder.
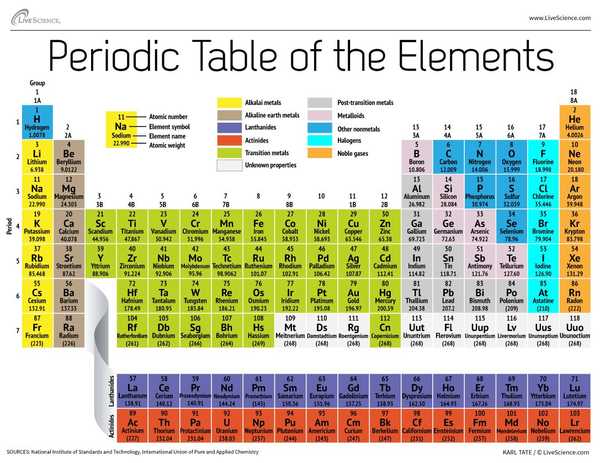
I dag, 150 år senere, genkender kemikere officielt 118 elementer (efter tilføjelsen af fire nykommere i 2016) og bruger stadig Mendeleevs periodiske tabel med elementer til at organisere dem. Tabellen starter med det enkleste atom, brint, og organiserer derefter resten af elementerne efter atomnummer, hvilket er antallet af protoner, som hver indeholder. Med en håndfuld undtagelser svarer elementernes rækkefølge til den voksende masse for hvert atom.
Tabellen har syv rækker og 18 kolonner. Hver række repræsenterer en periode; periodens antal for et element angiver, hvor mange af dets energiniveau huser elektroner. Natrium ligger for eksempel i den tredje periode, hvilket betyder, at et natriumatom typisk har elektroner i de første tre energiniveauer. Når man bevæger sig ned ad tabellen, er perioder længere, fordi det tager flere elektroner at udfylde de større og mere komplekse ydre niveauer.
Kolonnerne i tabellen repræsenterer grupper eller familier af elementer. Elementerne i en gruppe ser og opfører sig ofte på lignende måde, fordi de har det samme antal elektroner i deres yderste skal - det ansigt, de viser for verden. Gruppe 18-elementer, længst til højre på bordet, har for eksempel helt fulde ydre skaller og deltager sjældent i kemiske reaktioner.
Elementer klassificeres typisk som enten et metal eller ikke-metal, men skillelinjen mellem de to er uklar. Metalelementer er normalt gode ledere af elektricitet og varme. Undergrupperne i metallerne er baseret på de lignende egenskaber og kemiske egenskaber ved disse samlinger. Vores beskrivelse af den periodiske tabel bruger almindeligt accepterede grupperinger af elementer ifølge Los Alamos National Laboratory.
Alkalimetaller: Alkalimetallerne udgør det meste af gruppe 1, tabelens første søjle. Disse metaller er blanke og bløde nok til at skære med en kniv. Disse metaller starter med lithium (Li) og slutter med francium (Fr). De er også ekstremt reaktive og vil sprænge i flamme eller endda eksplodere ved kontakt med vand, så kemikere opbevarer dem i olier eller inerte gasser. Hydrogen lever med sin enkeltelektronik også i gruppe 1, men gassen betragtes som en ikke-metal.
Alkaliske jordmetaller: De jordalkalimetaller udgør gruppe 2 i det periodiske system, fra beryllium (Be) til radium (Ra). Hvert af disse elementer har to elektroner i det yderste energiniveau, hvilket gør de alkaliske jordarter reaktive nok til, at de sjældent findes alene i naturen. Men de er ikke så reaktive som alkalimetallerne. Deres kemiske reaktioner forekommer typisk langsommere og producerer mindre varme sammenlignet med alkalimetallerne.
lanthanider: Den tredje gruppe er meget for lang til at passe ind i den tredje søjle, så den brydes ud og vendes sidelæns for at blive øverste række på øen, der flyder i bunden af bordet. Dette er lanthaniderne, elementerne 57 til 71 - lanthanum (La) til lutetium (Lu). Elementerne i denne gruppe har en sølvfarvet hvid farve og pletter ved kontakt med luft.
aktinider: Actiniderne linjer øens nederste række og omfatter elementer 89, actinium (Ac), gennem 103, lawrencium (Lr). Af disse elementer forekommer kun thorium (Th) og uran (U) naturligt på Jorden i betydelige mængder. Alle er radioaktive. Aktiniderne og lanthaniderne danner sammen en gruppe kaldet de indre overgangsmetaller.
Overgangsmetaller: Vender vi tilbage til hovedkroppen i tabellen, repræsenterer resten af gruppe 3 til 12 resten af overgangsmetaller. Disse elementer er hårde, men formbare, skinnende og har god ledningsevne, hvad du typisk tænker på, når du hører ordet metal. Mange af de største hits i metalverdenen - inklusive guld, sølv, jern og platin - bor her.
Metaller efter overgang: Foran springet ind i den ikke-metale verden er delte egenskaber ikke pænt opdelt langs lodrette gruppelinjer. Metaller efter overgangen er aluminium (Al), gallium (Ga), indium (In), thallium (Tl), tin (Sn), bly (Pb) og vismut (Bi), og de spænder over gruppe 13 til gruppe 17. Disse elementer har nogle af de klassiske egenskaber ved overgangsmetaller, men de har en tendens til at være blødere og opføre sig dårligere end andre overgangsmetaller. Mange periodiske tabeller har en fed "trappelinje" under den diagonale forbindelsesbor med astatin. Metaller efter overgangen klynger sig nederst til venstre på denne linje.
metalloider: Metaloiderne er bor (B), silicium (Si), germanium (Ge), arsen (As), antimon (Sb), tellurium (Te) og polonium (Po). De danner trappen, der repræsenterer den gradvise overgang fra metaller til ikke-metaller. Disse elementer opfører sig undertiden som halvledere (B, Si, Ge) snarere end som ledere. Metalloider kaldes også "semimetaler" eller "dårlige metaller."
ikke-metaller: Alt andet øverst til højre på trappen - plus brint (H), strandet langt tilbage i gruppe 1 - er en ikke-metal. Disse inkluderer kulstof (C), nitrogen (N), fosfor (P), ilt (O), svovl (S) og selen (Se).
halogener: De fire øverste elementer i gruppe 17, fra fluor (F) til astatin (At), repræsenterer en af to undergrupper af ikke-metaller. Halogenerne er ret kemisk reaktive og har en tendens til at parre sig sammen med alkalimetaller for at producere forskellige typer salt. Bordsaltet i dit køkken er for eksempel et ægteskab mellem alkalimetallnatrium og halogenchlor.
Ædelgasser: Farveløse, lugtfri og næsten fuldstændigt ikke-reaktive, de inerte eller ædelgasser runder bordet ud i gruppe 18. Mange kemikere forventer, at Oganesson, et af de fire nyligt navngivne elementer, deler disse egenskaber; fordi dette element imidlertid har en halveringstid i millisekunderne, har ingen været i stand til at teste det direkte. Oganesson afslutter den syvende periode i det periodiske system, så hvis nogen formår at syntetisere element 119 (og løbet om at gøre det allerede er i gang), vil det løbe rundt for at starte række otte i alkalimetalsøjlen.
På grund af den cykliske natur, der er skabt af periodiciteten, der giver bordet sit navn, foretrækker nogle kemikere at visualisere Mendeleevs tabel som en cirkel.
Ekstra ressourcer:
- Se denne korte video om den periodiske tabel og elementgrupper fra Crash Course.
- Blad gennem denne interaktive periodiske tabel med elementer.
- Tjek denne gratis online uddannelsesressource for at forstå elementale grupper fra CK-12.















