
Thomas Dalton
0
1873
457
Redaktørens note: Denne historie blev opdateret den 17. august til at omfatte:
- Data fra en undersøgelse, der testede Modernes vaccine på rhesus macaque-aber
- Ny fase 1 / fase 2 datatestning Sinopharms kandidatvaccine
- Data for Johnson & Johnsons kandidatvaccine
Brug af materialer fra svækkede kolde vira til fragmenter af genetisk kode, skaber forskere over hele verden snesevis af unikke vaccinkandidater til at bekæmpe den nye coronavirus - og de gør det i en hidtil uset hastighed.
Over syv måneder efter, at Verdenssundhedsorganisationen (WHO) første gang advarede verden mod en mystisk klynge af tilfælde af lungebetændelse i Wuhan, Kina, er 167 kandidatvacciner under udvikling for at forhindre coronavirus, der forårsagede sygdommen (kaldet COVID-19), ifølge HVEM. De fleste af kandidatvaccinerne er i prækliniske stadier, hvilket betyder, at de stadig testes på dyr eller i laboratoriet, men en håndfuld af dem har nået menneskelige forsøg.
Sådanne kliniske forsøg er opdelt i tre til fire stadier, med tidligere faser (fase 1 / fase 2), der undersøger sikkerheden, doseringen og mulige bivirkninger og effektivitet (hvor godt det fungerer til at bekæmpe patogenet) af kandidatvaccinen i en lille gruppe mennesker, ifølge Food and Drug Administration (FDA). Nøglen til at få en kandidatvaccine godkendt viser imidlertid lovende resultater i det mere avancerede fase 3-forsøg.
Relaterede: Coronavirus live-opdateringer
I fase 3-forsøg tester forskerne effektiviteten af vaccinen, mens de overvåger for bivirkninger hos hundreder til tusinder af frivillige. FDA godkender derefter vaccinen, hvis forsøg viser, at den er sikker og effektiv, og fordelene ved vaccinen opvejer dens risici, ifølge Centers for Disease Control and Prevention (CDC). Fem coronavirus-vaccinekandidater er begyndt at rekruttere til eller gennemgår fase 3-forsøg ifølge WHO. Her er de mest lovende af disse kandidater:
University of Oxford / AstraZeneca

Vaccinen, der i øjeblikket kaldes ChAdOx1 nCoV-19, populært kendt som Oxford-vaccinen, udvikles af det britiske universitet i samarbejde med det farmaceutiske firma AstraZeneca. Vaccinen er lavet af en svækket version af en almindelig forkølelsesvirus, kaldet en adenovirus, der inficerer chimpanser. Forskere ændrede genetisk virussen, så den ikke kunne replikeres hos mennesker og tilføjede gener til kode for de såkaldte pigproteiner, som coronavirus bruger til at inficere humane celler. I teorien vil vaccinen lære kroppen at genkende disse pigge, så når en person udsættes, kan immunsystemet ødelægge det, ifølge en tidligere rapport.
Forskere testede tidligere denne vaccine i rhesus macaque-aber og fandt, at den ikke forhindrede aberne i at blive inficeret, når de bevidst blev udsat for coronavirus, men forhindrede dem i at udvikle lungebetændelse, hvilket antydede, at det delvist var beskyttende, ifølge en undersøgelse offentliggjort 13. maj. til fortryksdatabasen BioRxiv.
I april begyndte forskere at teste vaccinen på mennesker og offentliggjorde tidlige resultater fra deres fase 1 og stadig igangværende fase 2-forsøg den 20. juli i tidsskriftet The Lancet. Vaccinen forårsagede ikke nogen alvorlige bivirkninger hos deltagerne, men fik nogle milde bivirkninger, såsom muskelsmerter og kulderystelser. Vaccinen ansporede immunsystemet til at producere SARS-CoV-2-specifikke T-celler - en gruppe af hvide blodlegemer, der er vigtig i kampen mod patogener - og neutraliserende antistoffer, eller molekyler, der kan låse sig fast på virussen og blokere den fra at inficere celler ifølge rapporten.
Fase 3-forsøg er allerede begyndt i Brasilien og vil tilmelde op til 5.000 frivillige. En anden fase 3-undersøgelse forventes at tilmelde yderligere 10.500 mennesker i Storbritannien og 30.000 i U.S.A., ifølge Oxford-vaccine-forsøgswebsiden og The New York Times. Holdet i Oxford har også udtrykt interesse for at gennemføre udfordringsundersøgelser på mennesker, hvilket betyder, at de med vilje ville inficere frivillige med lav risiko med virussen, enten ved siden af fase 3-forsøg eller efter at de er færdige, ifølge The Guardian.
Det amerikanske ministerium for sundhed og menneskelige tjenester (HHS) annoncerede, at det ville give op til 1,2 mia. Dollars til AstraZeneca for at fremskynde vaccineudviklingsprocessen og for at hjælpe virksomheden med at fremstille mindst 300 millioner doser af vaccinen - hvis det viser sig at være sikker og effektiv - allerede i oktober 2020, ifølge en erklæring. Dette er en del af Trump-administrationens Operation Warp Speed, et initiativ, der sigter mod at levere 300 millioner doser af en sikker og effektiv vaccine inden januar 2021, ifølge HHS.
Sinovac Biotech
En anden kandidatvaccine, kaldet (PiCoVacc) og er udviklet af Beijing-baserede Sinovac Biotech, beskyttede rhesus-makakeaber mod infektion med den nye coronavirus, ifølge en undersøgelse offentliggjort 3. juli i tidsskriftet Science. Virksomheden, der allerede har vist, at vaccinen er sikker og effektiv i tidlige kliniske forsøg, rekrutterer til et klinisk fase 3 forsøg med 8.870 deltagere i Brasilien, ifølge clinicaltrials.gov.
Denne vaccine består af en inaktiveret version af SARS-CoV-2-virus. Inaktiverede vacciner er den døde version af patogenet, der forårsager sygdommen (i modsætning til svækkede vira, der er levende vacciner), ifølge den amerikanske afdeling for sundhed og menneskelige tjenester (HHS). Inaktiverede vira, såsom influenzavaccine eller hepatitis A-vaccine, er typisk ikke så beskyttende som levende vacciner og kan muligvis kræve boosterskud over tid, ifølge HHS. I modsætning hertil er Oxford-vaccinen en svækket form for en levende vaccine, som kan skabe langvarig immunrespons, men har en tendens til at være mere risikabel for mennesker med svækket immunsystem eller andre sundhedsmæssige problemer, ifølge HHS.
Sinovac begyndte fase 1 / fase 2-forsøg (involverende 743 raske voksne) i april i Jiangsu-provinsen i Kina. De gav deltagerne to doser af vaccinen med to ugers mellemrum og rapporterede, at vaccinen ikke forårsagede nogen alvorlige bivirkninger, ifølge en erklæring. Undersøgelsesforfattere sagde også, at mere end 90% af deltagerne havde udviklet neutraliserende antistoffer mod vaccinen to uger efter at have modtaget den anden dosis. Deres resultater er dog kun rapporteret i en pressemeddelelse og er endnu ikke blevet offentliggjort i et fagfællebedømt tidsskrift. Virksomheden gennemfører nu et fase 2-forsøg med ældre voksne og vil senere gennemføre en om børn og unge, ifølge en anden erklæring. Sinovac har tidligere brugt den samme teknologi til at skabe godkendte vacciner mod hepatitis A, hepatitis B og svineinfluenza, aviær influenza og virussen, der forårsager hånd-, mund- og klovesyge, ifølge STAT News.
Moderna / National Institute of Allergy and Infectious Diseases

Denne kandidatvaccine (mRNA-1273), udviklet af det amerikanske bioteknologiselskab Moderna og National Institute of Allergy and Infectious Diseases (NIAID), var den første, der blev testet på mennesker i USA, ifølge en tidligere rapport.
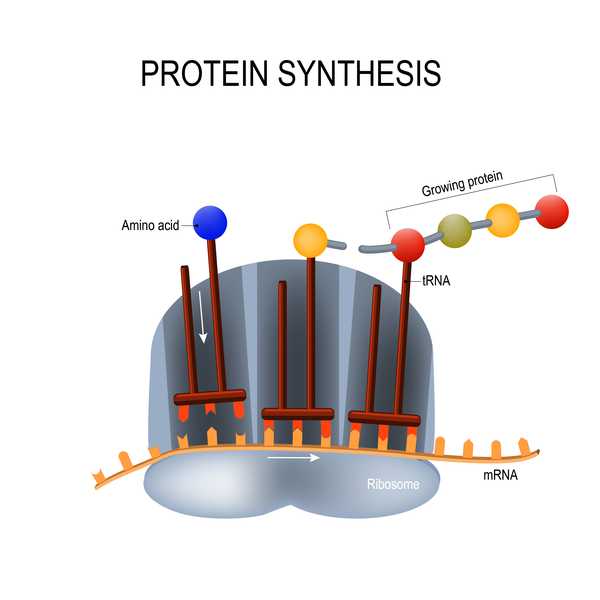
Modernas vaccine er afhængig af en teknologi, der hidtil ikke er blevet brugt i nogen godkendt vaccine: et stykke genetisk materiale kaldet messenger RNA (mRNA). Traditionelle vacciner består af svækkede eller inaktive vira eller proteiner fra disse vira for at udløse en immunrespons; mRNA-vacciner er derimod sammensat af genetisk materiale, der lærer cellerne selv at opbygge disse virale proteiner (i dette tilfælde coronavirus 'spike protein). Både traditionelle og mRNA-vacciner udløser en immunrespons i kroppen, så hvis en person naturligt udsættes for virussen, kan kroppen hurtigt genkende og bekæmpe den.
Disse mRNA-vacciner har flere fordele, herunder at de er hurtigere og lettere at fremstille end traditionelle vacciner, hvilket kan tage tid at udvikle sig, fordi forskere er nødt til at vokse og inaktivere hele patogener eller deres proteiner, ifølge National Geographic. mRNA-vacciner kan også være mere holdbare mod patogener, der har tendens til at mutere, såsom coronavira og influenzavirus. Imidlertid kan mRNA-vacciner forårsage bivirkninger i kroppen; disse typer vacciner har også problemer med stabilitet og nedbrydes ret hurtigt, hvilket kan begrænse immunitetsstyrken ifølge National Geographic.
mRNA-vacciner har vist sig at være et "lovende alternativ" til traditionelle vacciner, men "deres anvendelse er indtil for nylig blevet begrænset af ustabilitet og ineffektiv" levering i kroppen, rapporterede en gruppe forskere i en anmeldelse fra 2018, der blev offentliggjort i tidsskriftet Nature Reviews Drug Discovery. "De seneste teknologiske fremskridt har nu stort set overvundet disse problemer, og flere mRNA-vaccineplatforme mod infektionssygdomme og flere typer kræft har vist opmuntrende resultater i både dyremodeller og mennesker."
Den 14. juli offentliggjorde Moderna lovende tidlige resultater fra et fase 1-forsøg bestående af 45 deltagere i The New England Journal of Medicine. Deltagerne blev delt i tre grupper og fik en lav, medium eller høj dosis af vaccinen. Efter at have modtaget to doser af vaccinen udviklede alle deltagere neutraliserende antistoffer i niveauer over gennemsnittet af dem, der blev fundet i restituerede COVID-19 patienter, rapporteret.
Vaccinen syntes at være sikker og generelt godt tolereret, men mere end halvdelen af deltagerne havde nogle bivirkninger (svarende til bivirkninger, der kan ske fra det årlige influenzaskud), inklusive træthed, kulderystelser, hovedpine, muskelsmerter og smerter på injektionsstedet . Nogle deltagere i mellem- og højdosisgrupper oplevede feber efter den anden injektion. En person, der modtog den højeste dosis, oplevede ifølge rapporten en "svær" feber, kvalme, svimmelhed og en besvimelsesepisode. Men denne deltager følte sig bedre efter halvanden dag. Sådanne høje doser gives ikke til deltagere i kommende forsøg.
Modernas fase 2-forsøg pågår stadig, og den 27. juli startede virksomheden sin fase 3-prøve i U.S.A., ifølge en rapport. Forsøget forventes at tilmelde sig omkring 30.000 deltagere i slutningen af sommeren - og de første resultater fra forsøget kan være tilgængelige inden november, ifølge rapporten.
I april forpligtede HHS sig under Operation Warp Speed at bruge op til 483 millioner dollars til den hurtigere udvikling af Modernes vaccine.
Den 28. juli offentliggjorde forskere en ny i The New England Journal of Medicine, der beskrev hvordan Modernes vaccine inducerede en stærk immunrespons i rhesus-makak-aber. Efter at have fået en 10 eller 100 μg dosis af vaccinen og derefter en anden dosis to uger senere (nogle fik ikke en vaccine og fungerede som et sammenligningspunkt), aberne blev "udfordret" eller udsat for coronavirus i uge 8. Forskerne fandt, at aberne udviklede sig et stærkt immunrespons på virussen, da deres immunsystem producerede både neutraliserende antistoffer og T-celler. To dage efter, at aberne blev udsat for coronavirus, kunne forskerne ikke registrere nogen viral replikation i næsen eller lungerne, hvilket antydede, at vaccinen var beskyttet mod tidlig infektion. (Dette er i modsætning til University of Oxford-undersøgelsen udført hos aber, som syntes at forhindre aberne i at udvikle lungebetændelse, men ikke forhindrede dem i at blive inficeret med den nye coronavirus.)
CanSino Biologics / Beijing Institute of Biotechnology
CanSino Biologics udviklede i samarbejde med Beijing Institute of Biotechnology en kandidatvaccine ved hjælp af et svækket adenovirus. I modsætning til Oxford-vaccinen, der er afhængig af et adenovirus, der inficerer chimpanser, bruger CanSino Biologics et adenovirus, der inficerer mennesker.
Sammen med Moderna offentliggjorde denne gruppe også resultater fra deres fase 2-forsøg den 20. juli i tidsskriftet The Lancet. Forsøget, der blev udført i Wuhan (hvor de første coronavirus-tilfælde opstod), involverede 508 deltagere, der tilfældigt blev tildelt til at modtage en af to forskellige doser af vaccinen eller en placebo.
Denne undersøgelse fandt heller ikke alvorlige bivirkninger, skønt nogle rapporterede milde til moderate reaktioner, inklusive feber, træthed og smerter på injektionsstedet. Cirka 90% af deltagerne udviklede T-celle-responser og ca. 85% udviklede neutraliserende antistoffer ifølge undersøgelsen.
"Resultaterne fra begge undersøgelser forbedrer sig godt til fase 3-forsøg, hvor vaccinerne skal testes på meget større populationer af deltagere for at vurdere deres effektivitet og sikkerhed," sagde Naor Bar-Zeev og William J Moss, begge del af John Hopkins 'internationale vaccine Access Center, skrev i en ledsagende kommentar i The Lancet med henvisning til denne undersøgelse og Oxford-vaccineundersøgelsen offentliggjort i samme tidsskrift. "Generelt er resultaterne af begge forsøg stort set ens og lovende."
De ser nu ud til at gennemføre en fase 3-retssag uden for Kina, ifølge Reuters.
Sinopharm
Den statsejede China National Pharmaceutical Group (Sinopharm) kandidatvaccine er en inaktiveret form af SARS-CoV-2. Den 13. august offentliggjorde virksomheden data fra dets kliniske fase 1 og fase 2 forsøg i tidsskriftet JAMA. I fase 1-forsøget blev 96 raske voksne tilfældigt tildelt til at modtage enten en lav, medium eller høj dosis af vaccinen eller til at modtage aluminiumhydroxid som placebo. De fik anden og tredje dosering af vaccinen (eller placebo) efter henholdsvis 28 dage og 56 dage. Forskerne fandt, at vaccinen udløste deres kroppe til at producere neutraliserende antistoffer. Hos de deltagere, der modtog placebo, havde 12,5% bivirkninger. Hos dem, der modtog vacciner med lav, medium og høj dosis, havde henholdsvis 20,8%, 16,7% og 25% milde bivirkninger ifølge undersøgelsen. I fase 2-forsøget fik 224 voksne en medium dosis eller en placebo og derefter et andet skud enten 14 dage eller 21 dage efter den første. Igen udviklede deltagerne neutraliserende antistoffer og rapporterede nogle milde bivirkninger. Den mest almindelige bivirkning var smerter på injektionsstedet og derefter mild feber. "Ingen alvorlige bivirkninger blev bemærket," skrev forfatterne.
Virksomheden er allerede begyndt sin fase 3-retssag i Abu Dhabi, som vil rekruttere op til 15.000 mennesker, ifølge Reuters. Deltagerne modtager en af to vaccinstammer eller en placebo ifølge Reuters.
Pfizer / BioNTech / Fosun Pharmaceutical
Pfizer og det tyske bioteknologiselskab BioNTech udvikler ligesom Moderna en vaccine, der bruger messenger RNA til at få immunsystemet til at genkende coronavirus.
Vaccinen forårsagede ingen alvorlige bivirkninger og kunne anspore til et immunrespons ifølge data fra den tidlige fase 1 / fase 2 frigivet til den fortrykte database medRxiv den 1. juli, og som endnu ikke er peer-review. Undersøgelsen involverede 45 patienter, som fik en af tre doser af enten kandidatvaccinen eller en placebo. Ingen af patienterne havde alvorlige bivirkninger, men nogle udviklede bivirkninger såsom feber (75% i gruppen med den højeste dosis), træthed, hovedpine, kulderystelser, muskelsmerter og ledsmerter.
Forskerne fandt, at vaccinen fik immunsystemet til at frembringe neutraliserende antistoffer i niveauer 1,8 til 2,8 gange højere end dem, der findes i genvundne patienter, ifølge undersøgelsen. Senere annoncerede Pfizer nye resultater (i en pressemeddelelse, så konklusionerne ikke er peer-review), at vaccinen også fik produktionen af T-celler specifikke til den nye coronavirus.
Denne uge annoncerede Trump-administrationen en kontrakt på 1,95 milliarder dollars med Pfizer og BioNTech om at producere mindst 100 millioner doser af deres vaccine ved udgangen af året, hvis det viser sig at være sikkert og effektivt (med op til 500 millioner doser mere efter behov) . Amerikanerne ville modtage vaccinen gratis, ifølge The New York Times. Tidligere annoncerede de to virksomheder en aftale med Storbritannien om 30 millioner doser af vaccinkandidaten, hvis den fungerer og godkendes, ifølge en erklæring. Pfizer planlægger, at et fase 3-forsøg i stor skala starter denne måned og revision af lovgivningen allerede i oktober, ifølge Times.
Johnson & Johnsons Janssen farmaceutiske selskaber
Johnson & Johnsons Janssen eksperimentelle COVID-19-vaccine, kaldet Ad26, udvikles også fra et svækket adenovirus. Denne type vaccine kaldes en vektorbaseret vaccine, fordi den bruger en svækket virus (en vektor) til at levere information om patogenet til kroppen for at anspore til immunresponsen. I dette tilfælde udtrykker det svækkede adenovirus SARS-CoV-2 "spike" -proteinet. Janssen bruger den samme teknologi, som den brugte til at udvikle sin ebola-vaccine.
Forskere rapporterede den 30. juli i tidsskriftet Nature, at et enkelt skud af Ad26-vaccinen beskyttede rhesusmakaker mod infektion med SARS-CoV-2. I denne undersøgelse testede videnskabsmændene syv lidt forskellige typer Ad26-vaccineprototyper og identificerede den, der producerede det højeste antal neutraliserende antistoffer. Efter at have modtaget den valgte variant blev apene derefter udsat for coronavirus. Seks ud af syv aber, der fik denne prototypevaccine, kaldetAd26.COV2.S, og derefter udsat for coronavirus, viste ingen påviselig virus i den nedre luftvej, og en viste meget lave niveauer i næsen, ifølge udsagnet.
Johnson & Johnsons kliniske fase 1 / 2a-forsøg med Ad26.COV2.S er i gang i U.S.A. og Belgien. Forsøget forventes at tilmelde 1.045 sunde deltagere i alderen 18 til 55 år og personer over 65 år. De vil teste vaccinenes sikkerhed, eventuelle bivirkninger og immunresponset, som deltagerne udvikler, ifølge de seneste nyheder fra Johnson & Johnson . De vil også teste forskellige vaccinationsplaner og doser. Der er yderligere planer for en anden fase 1-undersøgelse af vaccinekandidaten i Japan og en fase 2-undersøgelse i Holland, Spanien og Tyskland, ifølge Johnson & Johnson. Hvis vaccinen viser sig at være sikker og effektiv i disse forsøg, vil forskerne begynde fase 3-forsøg i september med anslået 60.000 deltagere over hele kloden.
Johnson & Johnson annoncerede for nylig en aftale på 1 milliard dollar med den amerikanske regering om at levere 100 millioner doser af vaccinen i USA, hvis den modtager godkendelse eller tilladelse til brug i nødstilfælde fra den amerikanske Food and Drug Administration, ifølge en erklæring.
Se alle kommentarer (2)














